Körülbelül 4000, az Európai Unióban élő cisztás fibrózisos beteg válik most először jogosulttá egy olyan gyógyszerre, amely az alapbetegség okát kezeli
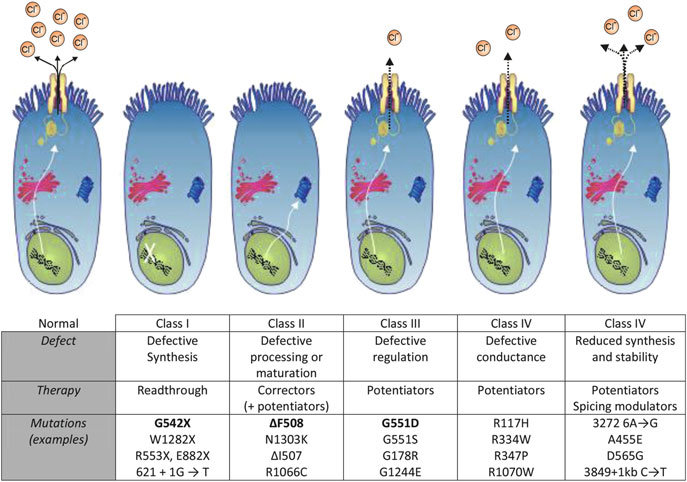
A Vertex Pharmaceuticals ma bejelentette, hogy az Európai Bizottság szabályozási jóváhagyást adott a KAFTRIO® (ivakaftor/tezakaftor/elexakaftor) alkalmazási előírásának bővítésére, ivakaftorral kombinációban, cisztás fibrózisban (CF) szenvedő betegek kezelésére. A jóváhagyásnak köszönhetően az indikáció kibővült minden olyan, 2 éves és idősebb betegre, aki legalább egy nem I. osztályú mutációval rendelkezik a cisztás fibrózis transzmembrán vezető (CFTR) génjében.
„Évek óta dolgozunk azon, hogy kezelési lehetőségeket biztosítsunk minden cisztás fibrózisos beteg számára, beleértve az ultra ritka mutációval rendelkezőket is” – mondta Dr. Carmen Bozic, a Vertex gyógyszerfejlesztési és orvosi ügyekért felelős ügyvezető alelnöke, valamint orvosigazgatója.
„Örömmel tölt el bennünket, hogy az Európai Bizottság kibővítette a KAFTRIO alkalmazási előírását minden olyan, 2 éves és idősebb CF-betegre, aki legalább egy nem I. osztályú mutációval rendelkezik, biztosítva ezzel, hogy még több CF-ben élő ember részesülhessen ebben az áttörést jelentő kezelésben.”
Az osztrák, dán, ír, norvég és svéd KAFTRIO támogatási megállapodásoknak, valamint a német egészségügyi rendszer hozzáférési lehetőségeinek köszönhetően ezekben az országokban a jogosult betegek hamarosan hozzáférhetnek a terápia kibővített indikációjához.
A Vertex továbbra is együttműködik az Európai Unióban a támogatási hatóságokkal annak érdekében, hogy minden jogosult beteg minél gyorsabban hozzáférhessen a kezeléshez.
Az eredeti hír innen elérhető



